العثور على هدف علاجي واعد لسرطان الغدد اللعابية النادر
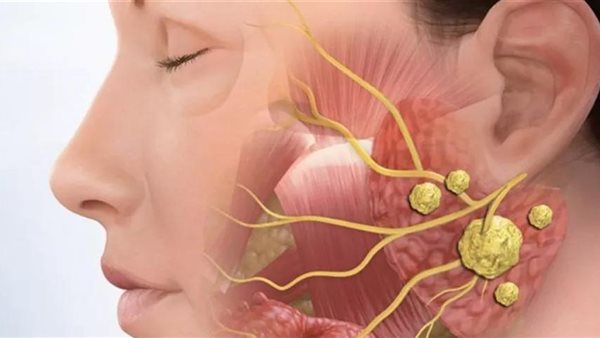
اكتشف الباحثون هدفًا علاجيًا واعدًا لسرطان الغدد الكيسية (ACC)، وهو نوع نادر من السرطان يصيب الغدد اللعابية وله خيارات علاجية قليلة.
نُشرت الدراسة في مجلة أبحاث السرطان التجريبية والسريرية.
وجدت الدراسة، التي قادها باحثون من مركز جامعة شيكاغو للسرطان الشامل، أن منع نشاط بروتين أرجينين ميثيل ترانسفيراز 5 (PRMT5) هو استراتيجية علاج محتملة ضد سرطان الخلايا الحرشفية.
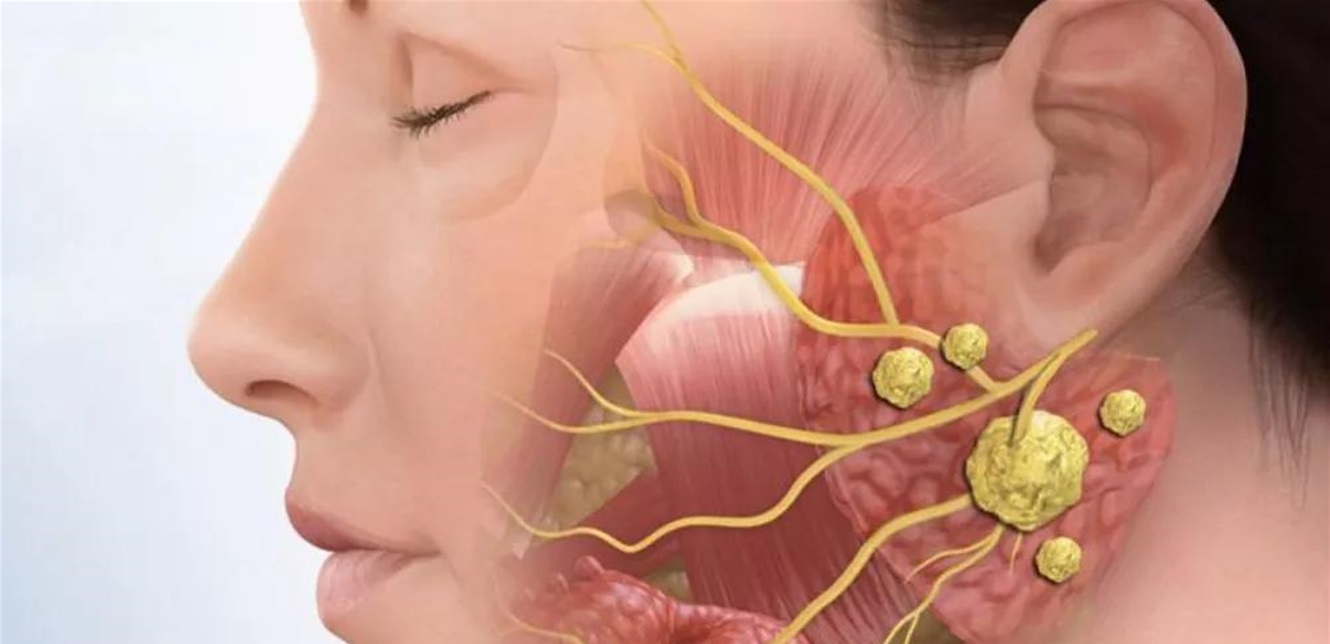
سرطان الخلايا الحرشفية
يشكل سرطان الخلايا الحرشفية 1-5% فقط من سرطانات الرأس والرقبة و25-35% من أورام الغدد اللعابية.
أوضح الدكتور يفغيني إيزومتشينكو، أستاذ الطب المساعد بجامعة شيكاغو، أن "المرض بحد ذاته نادر جدًا، مما يجعل دراسته صعبة للغاية". وأوضح أنه بالإضافة إلى ندرته، يصعب أيضًا اكتشافه مبكرًا لأن المرضى لا تظهر عليهم الأعراض إلا بعد تطور المرض بشكل ملحوظ.
وقال إيزومتشينكو: "لا نعرف الكثير عن هذا المرض، ولا نعرف الكثير عن كيفية علاجه، ولا يوجد لدينا تاريخ غني للمرضى الذين عولجوا حتى يمكننا الرجوع إليه وتحديد النهج الأفضل".
ونظرا لعدم وجود علاجات مستهدفة لسرطان الخلايا الحرشفية، لجأ الفريق إلى الذكاء الاصطناعي، الذي اكتسب زخما في اكتشاف أهداف علاجية جديدة.
باستخدام أداة اكتشاف تنبؤي قائمة على الذكاء الاصطناعي، حلل الفريق بيانات التعبير الجيني من 87 عينة من أورام سرطان الخلايا الحرشفية (ACC) و35 عينة مطابقة من الضوابط الطبيعية لتحديد أهداف دوائية محتملة.
من بين أبرز المرشحين كان إنزيم PRMT5، وهو إنزيم مشارك في التنظيم الجيني (تغيير التعبير الجيني ونشاط البروتين دون تغيير تسلسل الحمض النووي نفسه)، ومعروف بدوره في تطور السرطان.
بمجرد تحديد PRMT5 كهدف واعد، تعاون الباحثون مع شركة Prelude Therapeutics، وهي شركة طورت مثبطًا انتقائيًا للغاية لـ PRMT5 يُسمى PRT543.
قيّم الباحثون PRT543 في نماذج خلوية وحيوانية، بما في ذلك سلالات خلايا ACC (خلايا مشتقة من أنسجة سرطانية)، والعضيات (نماذج أورام ثلاثية الأبعاد مشتقة من عينات المرضى)، وزراعات أجنبية مشتقة من المرضى (PDXs)، وهي أورام بشرية مزروعة في الفئران.
أوضح إيزومتشينكو قائلاً: "تُعدّ العضويات أفضل لتقييم استجابة الدواء، لأنها تُمثّل التركيب الجيني للسرطان بشكل أفضل مقارنةً بخطوط الخلايا. وهذا يُعزز الثقة في فعالية المركّب، إذ يُثبّط الخلايا نفسها التي تُحفّز تطور السرطان".
أظهرت النتائج أن تثبيط PRMT5 أدى إلى قمع نمو الورم بشكل كبير عبر نماذج ما قبل السريرية المتعددة، مما أدى إلى انخفاض تنظيم الجينات الرئيسية المرتبطة بسرطان الخلايا الحرشفية مثل MYB وMYC.
ويبدو أن العلاج كان فعالاً أيضًا بغض النظر عما إذا كانت الأورام تحمل طفرات في NOTCH1، وهو جين مرتبط بسرطان الخلايا الحرشفية الأكثر عدوانية.
وفي حين وجدت التجارب السريرية المبكرة أن مثبطات PRMT5 تظهر نشاطًا مضادًا للأورام في أنواع مختلفة من السرطان، إلا أن فعاليتها في علاج سرطان الخلايا الحرشفية لم يتم استكشافها بالكامل حتى الآن.
وقال إيزومتشينكو: "وجدنا أن الدواء، وإن كان فعالاً، إلا أنه ليس دواءً خارقاً، فهو يثبط الأورام ويُقلص حجمها، ويُظهر تأثيرات على سلالات الخلايا والعضيات ونماذج PDX، ولكنه لا يُعالج المرض".
وللوصول إلى "علاج" حقيقي، استكشف الباحثون علاجات مركبة محتملة لتعزيز فعالية PRT543.
وأضاف إيزومتشينكو أنه "في علاج السرطان حاليًا، تُعتبر كلمة "مزيج" هي الكلمة المفتاحية، نجمع عدة أدوية معًا لتثبيط مسارات رئيسية، ونأمل أن يُحدث مزيج الدواءين أو الثلاثة معًا تأثيرًا أفضل من كل دواء على حدة".
استكشف الفريق أدويةً معتمدةً بالفعل لعلاج الأورام الصلبة، وحددوا لينفاتينيب، وهو مثبط متعدد الكينازات، كعلاجٍ محتمل. وقد أدى هذا العلاج المركب إلى تأثيرٍ مثبطٍ أقوى على نمو الورم في المختبر.
ومن الجدير بالذكر أن مجموعة فرعية من مرضى جامعة شيكاغو ميديسن الذين استخدموا في تحليل الباحثين أظهرت ارتفاعًا في التعبير عن PRMT5 إلى جانب مستويات مرتفعة من جينات MYC وMYB وLenvatinib المستهدفة.
تشير هذه النتائج إلى أن استهداف إشارات PRMT5 بالاشتراك مع Lenvatinib يمكن أن يكون استراتيجية واعدة للمرضى الذين لديهم هذا الملف الجزيئي المحدد.
وأشار إيزومتشينكو إلى أننا نعتقد أن المرضى الذين يحملون هذا التوقيع الجزيئي هم مرشحون محتملون للعلاج المركب.
تسلط هذه الدراسة الضوء على التحول نحو علاجات أكثر تخصيصًا واستهدافًا لعلاج السرطان.



