اكتشاف جديد بخصوص فيروس نوروفيروس.. ما التفاصيل؟
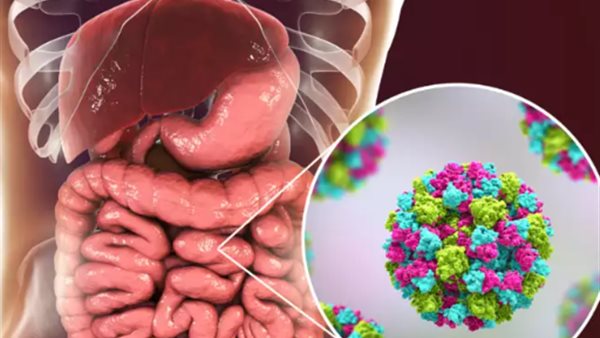
الفيروس النوروفيروسي البشري، وهو فيروس ذو سلسلة إيجابية من الحمض النووي الريبوزي، هو السبب الرئيسي لالتهاب المعدة والأمعاء الفيروسي.
يتسبب هذا الفيروس في ما يقدر بنحو 685 مليون حالة وحوالي 212 ألف حالة وفاة سنويًا على مستوى العالم، ولا يوجد له أي لقاحات أو مضادات فيروسية معتمدة.
تمهيدًا لتحسين العلاجات الدوائية، أعلن باحثون في كلية بايلور للطب ومركز إم دي أندرسون للسرطان بجامعة تكساس في تقرير نشر في مجلة Science Advances، عن اكتشاف مراكز تكاثر الفيروس النوروفيروسي البشري، وهو ما قد يؤدي إلى تصميم أدوية مضادة للفيروسات للوقاية من هذه العدوى أو السيطرة عليها أو علاجها.
مصانع تكاثر الفيروسات
وبحسب موقع ميديكال إكسبريس، قال المؤلف الأول الدكتور سوني كاوندال: "عندما تصيب الفيروسات الخلايا، فإنها عادة ما تخلق حجرات متخصصة - مصانع للتكاثر - حيث تشكل فيروسات جديدة تصيب المزيد من الخلايا مسببة المرض".
وأضاف أنه "مع ذلك، لا يُعرف إلا القليل عن مصانع تكاثر الفيروس النوروفيروسي".
تشير الأدلة المتزايدة إلى أن بعض مصانع التكاثر لا تنفصل عادةً عن محيطها بغشاء، بل إنها عبارة عن مكثفات جزيئية حيوية، وهي هياكل تشبه الفقاعة التي تتشكل عن طريق فصل الطور السائل عن الطور السائل.
تتضمن هذه المكثفات بشكل انتقائي البروتينات والمواد الأخرى اللازمة للتكاثر الفيروسي.
وقد تمت دراسة المكثفات الشبيهة بالسوائل كمصانع للتكاثر على نطاق واسع في فيروسات أخرى، بما في ذلك فيروسات داء الكلب والحصبة.
في هذه الدراسة، حقق الباحثون فيما إذا كان فيروس نوروفيروس يشكل مكثفات جزيئية حيوية تعمل كمحاور للتكاثر.
وقال كوندال: "كنا نعلم أن هذه المكثفات عادة ما تبدأ بواسطة بروتين فيروسي واحد قادر على ربط المادة الوراثية، وله منطقة مرنة ويشكل أوليغومرات، وهي جزيئات تتكون من أعداد صغيرة من الوحدات المتكررة".
بدأ الفريق تحقيقه من خلال تطبيق التحليل المعلوماتي الحيوي لتحديد بروتينات الفيروس النوروفيروسي التي من شأنها أن تظهر الخصائص التي من المرجح أن تؤدي إلى تكوين المكثفات السائلة.
وقال كوندال: "من خلال العمل مع سلالة فيروس نوروفيروس البشرية GII.4، المسؤولة عن التسبب في معظم حالات التهاب المعدة والأمعاء في جميع أنحاء العالم، وجدنا أن بوليميراز الحمض النووي الريبي المعتمد على الحمض النووي الريبي لديه أعلى ميل لتكوين مكثفات جزيئية حيوية".
وأضاف: "يتميز هذا البروتين بمنطقة مرنة، ويمكنه تكوين وحدات أوليجوميرية، ويرتبط بالحمض النووي الريبوزي، المادة الوراثية للفيروس النوروفيروسي، ويلعب دورًا أساسيًا أثناء تكاثر الفيروس، حيث يصنع نسخًا من الحمض النووي الريبوزي الفيروسي، كل هذه الخصائص دفعتنا إلى اختبار ما إذا كان بوليميراز الحمض النووي الريبوزي GII.4 يحفز تكوين مكثفات جزيئية حيوية مواتية لتكاثر الفيروس تجريبيًا".
قال براساد، أستاذ علم الفيروسات الجزيئية وعلم الأحياء الدقيقة ورئيس قسم الكيمياء الحيوية ألفين رومانسكي في جامعة بايلور: "تُظهر دراساتنا التجريبية أن بوليميراز RNA GII.4 يشكل بالفعل مكثفات شبيهة بالسوائل عالية الديناميكية في ظل ظروف فسيولوجية ذات صلة في المختبر وأن المنطقة المرنة من هذا البروتين ضرورية لهذه العملية".
وأضاف براساد: "علاوة على ذلك، فإن المكثفات عبارة عن هياكل ديناميكية للغاية: حيث يمكن للعديد منها أن تندمج لتشكل هيكلًا أكبر، أو يمكن أن تنقسم إلى هياكل أصغر؛ كما تتحرك داخل الخلية، وتتبادل المواد مع محيطها".
وبعد ذلك، قام الباحثون بالتحقيق فيما إذا كانت هذه المكثفات الشبيهة بالسوائل تتشكل أيضًا في الخلايا المعوية البشرية المصابة بفيروس نوروفيروس.
حتى وقت قريب، كان من الصعب دراسة كيفية تكاثر الفيروس النوروفيروسي داخل الخلايا لأن الباحثين كانوا يفتقرون إلى نظام بيولوجي فعال لزراعة الفيروس في المختبر، ولكن في عام 2016، نجح مختبر الدكتورة ماري إستس في بايلور وزملاؤها في زراعة سلالات فيروس النوروفيروس البشرية في مزارع معوية بشرية.
وقال براساد: "أظهرنا أن المكثفات الشبيهة بالسوائل تتكون في مزارع الأمعاء البشرية المصابة بفيروس نوروفيروس وكذلك في سلالة الخلايا البشرية HEK293T المزروعة في المختبر، ونقترح أن هذه المكثفات هي مراكز تكاثر لفيروس نوروفيروس البشري، وهو حل أنيق للسؤال المحير حول كيفية فصل الترجمة بمساعدة الريبوسوم للجينوم الفيروسي عن تكاثره بواسطة بوليميراز الفيروس في فيروسات الحمض النووي الريبي ذات السلسلة الإيجابية".
وأضاف: "أظهر تحليلنا للمعلومات الحيوية أيضًا أن بوليميرات الحمض النووي الريبوزي لجميع سلالات الفيروس النوروفيروسي تقريبًا لديها ميل كبير لتشكيل مصانع التكاثر هذه، مما يشير إلى أن هذه قد تكون ظاهرة شائعة في معظم فيروسات النوروفيروس".
لا تقدم النتائج نظرة جديدة حول تكاثر فيروس نوروفيروس البشري فحسب، بل تفتح أيضًا أهدافًا جديدة لتصميم مضادات الفيروسات لعدوى فيروس نوروفيروس البشري، والتي لا تزال تشكل تهديدًا خطيرًا للأطفال والمرضى الذين يعانون من ضعف المناعة.



